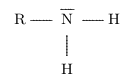Modéliser des transformations acide-base par des transferts d’ion hydrogène \( \ce{H+} \)
Réaction acido-basique
En classe de 1ère, on a découvert les réactions d'oxydo-réduction où des électrons sont
échangés un réducteur qui donne des électrons et un oxydant qui en accepte.
On a aussi pu dégager la notion de couple redox : un réducteur qui cède des électrons se transforme en son
oxydant conjugué et vice-versa : couple Ox/Red.
Il existe une autre grande famille de réactions où des protons, ou ion hydrogène \( \ce{H+} \), sont
échangés : ce sont les réactions acido-basique.
En effet, selon la théorie de Brönsted, un acide est une espèce chimique susceptible de céder un proton
; et une base est une espèce chimique susceptible de capter un proton.
Lorsqu'un acide perd un proton, il se transforme en sa base conjuguée. Symétriquement, lorsqu'une base gagne un
proton, elle se transforme en son acide conjugué.
On retrouve ici la notion de couple. Un couple acide-base se note Acide/Base.
Exemples :
- Acide : \( \ce{HA = A- + H+} \)
\( \ce{HCl = Cl- + H+} \)
\( \ce{CH3COOH = CH3COO- + H+} \)
- Base : \( \ce{B + H+ = BH+} \)
\( \ce{NH3 + H+ = NH4+} \)
\( \ce{HO- + H+ = H2O} \)
- Réaction acido-basique : transfert de proton de l'acide d'un couple vers la base d'un autre couple.
Exemple : couples \( \ce{ CH3COOH/CH3COO-} \) et \( \ce{NH4+/ NH3} \)
$$ \ce{$\underset{\text{acide 1}}{\ce{CH3COOH}}$ + $\underset{\text{base 2}}{\ce{NH3}}$ +
<=>
$\underset{\text{base 1}}{\ce{CH3COO-}}$ +
$\underset{\text{acide 2}}{\ce{NH4+}}$
}$$
Quelques couples acide-base à connaître
- Toutes les molécules de la famille des acides carboxyliques \( \ce{RCO2H} \) (vu en 1ère)
sont des acides (ben oui !).
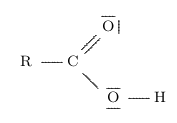
L'hydrogène lié à l'oxygène peut facilement être perdu pour former un ion carboxylate :
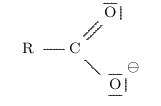
L'acide éthanoïque se transforme par exemple en sa base conjuguée, l'ion éthanoate : ils forment le
couple \( \ce{CH3COOH} \) / \( \ce{CH3COO^-} \).
- Les amines sont les molécules qui portent le groupe caractéristique amino
\( \ce{NH2 -} \).
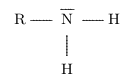
L'atome d'azote peut facilement gagner un proton pour former un ion ammonium :
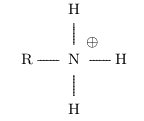
L'ammoniac \( \ce{NH3} \) se transforme par exemple en en son acide conjugué, l'ion éthanoate : ils
forment le couple \( \ce{NH4+} \) / \( \ce{NH3} \).
- L'acide carbonique (dioxyde de carbone en solution) perd un proton pour former sa base
conjuguée, l'ion hydrogénocarbonate :
Ils forment le couple \( \ce{CO2} \),\( \ce{H2O} \) / \( \ce{HCO3-} \) ; on écrit aussi \( \ce{H2CO3} \)
/ \( \ce{HCO3-} \).
Cas particulier de l'eau : espèce amphotère
La molécule d'eau peut réagir comme un acide et perdre un proton pour former l'ion
hydroxyde \( \ce{HO-} \) :
\( \ce{H2O = H+ + HO- } \)
Mais elle peut aussi réagir comme une base et gagner un proton pour former l'ion
oxonium \( \ce{H3O+} \) :
\( \ce{H2O + H+ = H3O+ } \)
L'eau appartient donc 2 couples acide/base :
\( \ce{H3O+} \) / \( \ce{H2O} \) en tant que base, et
\( \ce{H2O} \) / \( \ce{HO-} \) en tant qu'acide.
Les espèces qui peuvent jouer un rôle d'acide et de base sont des espèces amphotères.
C'est par exemple aussi le cas de l'ion hydrogénocarbonate qui appartient aux couples :
\( \ce{CO2} \),\( \ce{H2O} \) / \( \ce{HCO3-} \) en tant que base
\( \ce{HCO3-} \) / \( \ce{CO3^2-} \) en tant qu'acide
Extrait du programme
| Notions et contenus |
Capacités exigibles |
Transformation modélisée par des transferts d’ion hydrogène \( \ce{H+} \) : acide et base de Brönsted,
couple acide-base, réaction acide-base.
Couples acide-base de l’eau, de l’acide carbonique, d’acides carboxyliques, d’amines
Espèce amphotère.
|
Identifier, à partir d’observations ou de données expérimentales, un transfert d’ion hydrogène, les
couples acide-base mis en jeu et établir l’équation d’une réaction acide-base.
Représenter le schéma de Lewis et la formule semi-développée d’un acide carboxylique, d’un ion
carboxylate, d’une amine et d’un ion ammonium.
Identifier le caractère amphotère d’une espèce chimique. |